

导语:
今年2月,Apollomics(冠科美博)对外宣布了新的合作动向,接连引进三款first in class抗肿瘤产品,打响了2021年的“第一枪”。这里面既包含了ErbB、Wnt/β-catenin信号通路,也涉及到免疫检查点主动控制剂(ACCI),在当前火热的“后PD-1”时代,无疑都让人眼前一亮。
而去年,冠科美博更是超额完成任务,不仅拿到1.24亿美元C轮融资,其用于治疗成人复发或难治性AML治疗的重磅产品Uproleselan注射液(APL-106),也提前被CDE纳入突破性治疗品种。
对于此次引进三款first in class抗肿瘤产品的策略布局对冠科美博而言意味着什么?三款药物具体带来哪些变革?而下一步,冠科美博又将如何把产品推向市场?新药研发交流分享平台同写意近期采访了冠科美博CEO余国良,以及中国区总经理兼科研负责人施前,两位向同写意梳理冠科美博的发展逻辑。
抗肿瘤的“黄金三角”
“我本来以为要等到2021年,APL-106才会在国内被纳入突破性疗法。”余国良回应说,此前9月份,APL-106获批开展的I期和III期桥接临床研究,也比预期提前了近两个月。除了团队的执行力之外,这也与药物背后的创新机制有关。
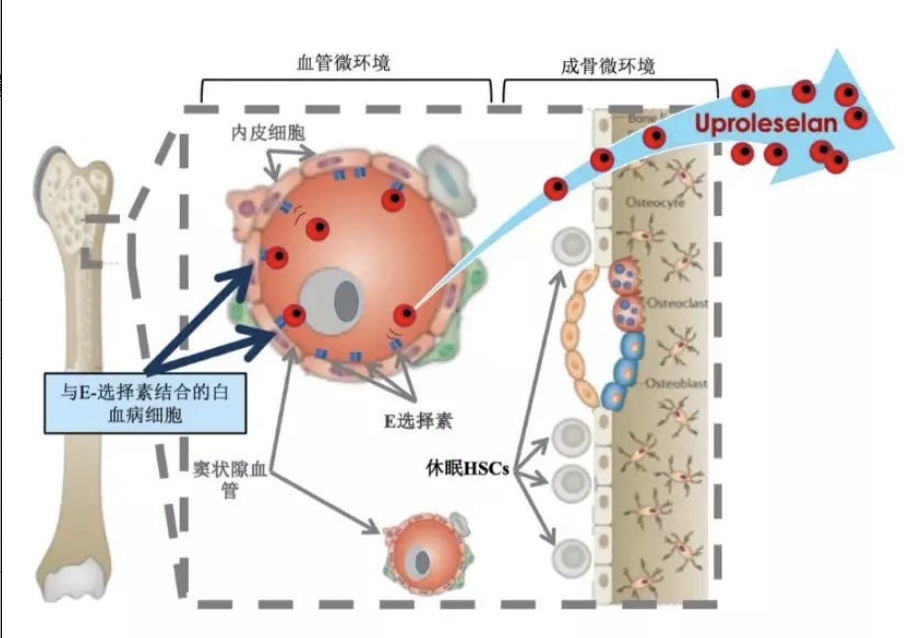
APL-106能阻断骨髓细胞上的一种粘附分子E-选择素与血液癌细胞结合,进而阻断骨髓微环境中白血病细胞的耐药机制。形象地看,就是把肿瘤细胞从人的骨髓或组织里赶出来,再通过药物将其杀死。
 图丨APL-106作用机制
图丨APL-106作用机制
简单,但聪明——这是余国良对APL-106机制的评价。“如果不是用我们的思路去钻研挖掘,很多公司可能不会发现这个药,也看不懂。”
某种程度上说,此次引进三款first in class抗肿瘤产品的策略,早在APL-106上就得到了实践。2020年1月,冠科美博从美国GlycoMimetics获得APL-106的国内开发及商业化权益。早期研究发现,APL-106与其他抗肿瘤药物联用,能很好得提高药效,增强杀伤肿瘤细胞的能力。
余国良并不看重一个药物是大分子抑或小分子,“这些都只是工具,最终目标是要让癌症患者得到有效的治疗”。因此,他给冠科美博的定位也十分明确,借助不同靶点、活性或机制的药物联用,最大程度地改善治疗效果。
“癌症属于异质性的疾病,很多因素都会造成癌症的进展和耐药。所以癌症治疗本就是场持久战,想要消除肿瘤,不能只盯着一个靶点、机制。”余国良补充说。
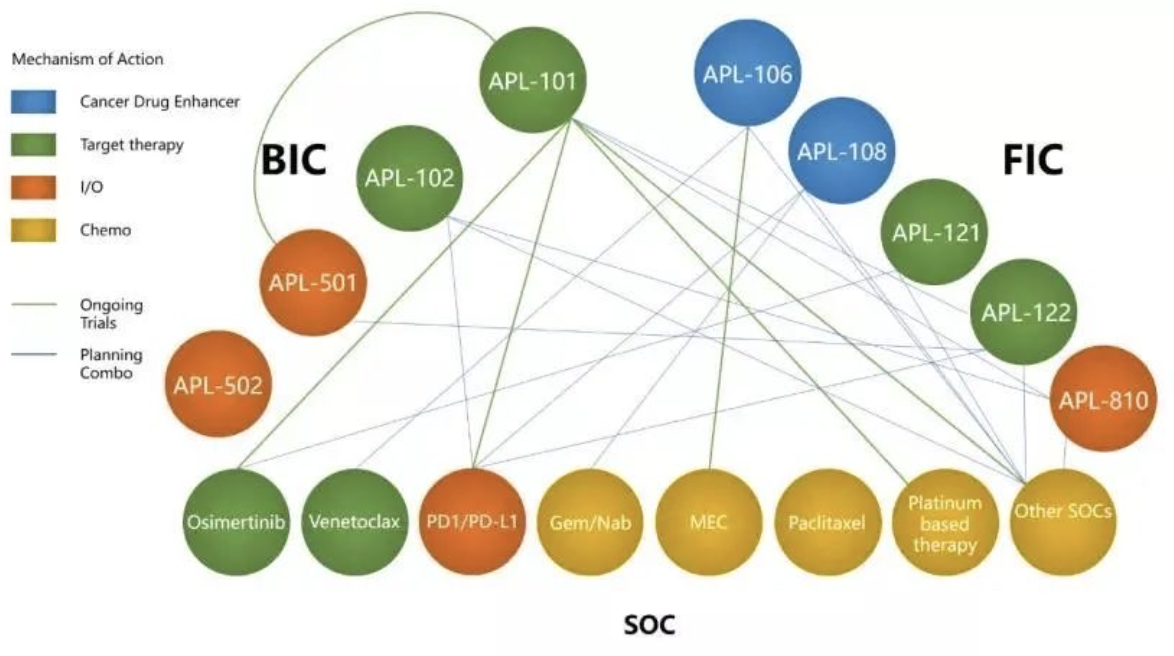
余国良认为,肿瘤治疗的未来是组合疗法。而这种组合,则包含了标准疗法与best in class、first in class的协同。目前,冠科美博已经储备了近10款产品,形成了抗肿瘤的“黄金三角”。
 图丨冠科美博抗肿瘤产品的“黄金三角”
图丨冠科美博抗肿瘤产品的“黄金三角”
“标准疗法(SOC)是基础,像较为成熟的PD-1或者PD-L1抗体,冠科美博都会考虑纳入到自己的管线布局里,并且希望做到best in class。此外,我们也在探索一些非常有潜力的靶点,例如APL-101,它可靶向多种肿瘤c-Met失调通路,现在已经在15个国家和地区开展II期临床试验,并启动了和K药、奥西替尼等重磅肿瘤药的联用。”余国良进一步比喻道,“通过这一黄金三角,希望编织一个联合治疗的密网,将危害人类健康的肿瘤一网打尽。”
透过这一“黄金三角”,冠科美博希望能桥连东西方创新,把中国的资源和创新带向全球,成为抗肿瘤新药开发的全球领导者,最终实现攻克癌症的目标。
“新式武器”入场
余国良把创新药的发展一分为二,而当下的中国,正在经历从技术创新到科学创新的变革。
值得注意的是,技术创新,也就是通常说的fast follow,主要针对在科学上已经被验证或者成功的靶点,通过技术水平的提高或者创新以实现药物开发。“问题是,太多fast follow可能会导致赛道过于拥挤,投资回报率下降。”余国良担心,中国新药如果没有门槛和差异化,产品必然同质化。
除商业价值的考量,转向具有全球原创性或差异化的产品的必要性,也可以在需求端找到支撑。以APL-106开发的方向为例,复发或难治性AML因其自身特性难以达到完全缓解,并发症多,生存期短,患者亟需新的区别于现有疗法的治疗方案。
First in class,就提供了这样的“新式武器”。但以技术层面看,全球首创药物开发的难点之一在于找对靶点,这需要强大的基础科研能力。因此,中外联合推进项目,无疑增加创新落地的可能。
“学术界和工业界应该更加专注于自己的擅长领域,从科学到药物上市是一场接力赛,做好分工合作是提高效率和成功率的关键。”余国良建议说。此次引进的三款first in class产品,将极大地扩充冠科美博的“弹药库”,进一步加强“黄金三角”的协同效应,从而探索更多的攻克肿瘤的疗法。
其中,EO1001 (APL-122)作为口服不可逆的广谱ErbB小分子抑制剂,可靶向ErbB受体1(EGFR)、2(HER2)、4(HER4),用于治疗脑胶质瘤和其他实体肿瘤脑转移。
“失调的ErbB信号传导与包括胶质母细胞瘤(GBM)在内的实体瘤的发展有关,其中约45%具有EGFR扩增和/或突变。”冠科美博中国区总经理兼科研负责人施前介绍,“不幸的是,由于现有已上市的ErbB小分子抑制剂的中枢神经系统渗透性差,导致在临床环境中并未显示出对GBM及肺癌脑转移的显著抗肿瘤活性。”
此前,施前在中美冠科工作逾7年,曾担任太仓公司总经理、肿瘤学副总裁,领导体外和体内肿瘤药理学和PDX团队。而通过APL-122的临床前研究,施前看到了这个产品优异的血脑屏障穿透性,这将有可能成为治疗脑胶质瘤及肺癌脑转移的一类新药。
比APL-122进展更快的Tegavivint(APL-121),正在硬纤维瘤病人中进行1/2a期临床试验,安全性良好。根据既往资料,Wnt/β-catenin信号通路在多种肿瘤中异常激活,而APL-121具有独特的机制,它通过抑制细胞核内的TBL1特异性抑制该通路,这让其有比其他β-catenin抑制剂更好的专一性和更小的毒性,具有广阔的临床前景。
而说到应用层面,主动免疫检查点控制剂(ACCI)重组疫苗TYG-100(APL-810)背后的专利技术想象空间要大得多。该技术创造性的将三个不同的机制整合到同一个分子中,包括靶向抗原(如G17)、靶向传递抗原到抗原呈递细胞(如DC和B细胞)以及CpG特异激活TLR9。
“这三个机制的有机结合,能同时激活抗原特异的T细胞反应和B细胞反应,使机体的免疫系统充分调动来杀伤肿瘤。当这一平台系统在临床得到验证后,我们能很容易的替换抗原靶标,比方说替换为Her2来针对乳腺癌,替换成EGFR来针对肺癌等。”施前解释说,这将有助于扩大覆盖的适应症,使更多的肿瘤患者受益。
APOLLO的新征程
2019年,冠科美博开启APL-101(c-Met抑制剂)与APL-501(PD-1单抗)的联合用药试验,并以Apollo trial(阿波罗试验)命名。
余国良解释说,在希腊神话中,阿波罗是“治愈之神”。而癌症不分国界,“我们应该充分发挥中美两国的科学技术和临床资源的长处”,推动国际同行在联合治疗上的合作。
“我们会沿袭APL-101项目获得的全球临床试验经验,在全球多个国家开展APL-122的临床I期单药及后期单药和联合用药的试验。”施前透露,这一产品既可能与冠科美博的管线产品,如C-Met、PD-1、Uproleselan有很好的联合效性,又具备与肿瘤SOC联合的潜力。
而对于APL-810的临床前研究工作及IND,冠科美博也在如期进行,首先计划进行消化道肿瘤的适应症研究。“中国是消化道肿瘤高发地区之一,APL-810的临床开发,将给中国的肿瘤患者,尤其是胰腺癌患者带来新的希望。作为全新的肿瘤免疫治疗方案,APL-810也可能会和公司管线中的多个靶向药物以及标准治疗产生联合效应。”施前补充解释说。
另外,APL-121也将被纳入阿波罗试验里,计划在中国开展临床I期的PK和安全性试验、临床II期在肺癌、AML和骨肉瘤等肿瘤中的联合治疗。
经过前几年的资本涌入,余国良原本预测,2020年底国内生物技术行业迎来一段冷静期。但受到COVID-19疫情的影响,他认为“这一天的到来可能还要往后延迟两三年”。“现在看,整个行业还是会继续处在一个快速向上的发展阶段,这也是每个公司寻找‘差异化’的时机。”余国良最后说,只有真正找到自己的独特优势,才能最终推动产品上市,持续为癌症患者带来价值。