

日前,检验医学领域的Top3期刊Clin Chim Acta刊登了阅尔基因与复旦大学附属中山医院检验科郭玮教授课题组合作的重要研究成果。该项研究共纳入195名肺癌患者,采用其组织和血液样本比较了Super-ARMS和BDA Sanger技术在检测EGFR突变中的表现,研究表明传统金标准Sanger加上BDA后,灵敏度与NGS相当,并较Super- ARMS能检出更多变异,其中包括能使患者从治疗中获益。这也进一步说明BDA Sanger测序是临床分子诊断的有效方法。
研究背景
血液中的循环肿瘤DNA(circulating tumor DNA,ctDNA)是检测肿瘤基因变异和评估药物响应的非侵入性样本,基于ctDNA 的EGFR突变检测能够指导EGFR靶向用药。NGS(Next Generation Sequenceing)在液体活检中具有广泛的应用,但是与qPCR相比,实验周期长,检测成本高。针对少部分位点的检测,操作更便捷的qPCR和一代测序(Sanger)平台在临床上依然有巨大的应用价值。
Sanger测序技术可以检测待测位点的突变,但其灵敏度只有15%,ctDNA的突变频率在很多情况下都低于15%,因此,需要联合一些低频检测技术才能使得Sanger测序的灵敏度达到液体活检的要求。
ARMS- PCR技术是一项实验室常见的技术,其原理是建立在等位基因特异性延伸反应基础上,只有当某个等位基因特异性引物的3’末端碱基与突变位点处碱基互补时,才能进行延伸反应,即引物3’端错配的碱基会导致PCR引物延伸速度变慢,当错配达到一定程度时,引物延伸将终止,得不到特异长度的PCR扩增产物,从而提示模板DNA没有与引物3’端配对的碱基,反之则有。此外,新型检测技术BDA可赋能Sanger测序平台进行液体活检。
BDA技术通过Blocker与野生型序列更紧密结合,抑制PCR前向引物扩增野生型序列,使得突变型序列被放大数千数万倍,通过一代测序平台和qPCR平台也可轻松判读1。这使得基因组分析对研究人员和临床医生来说,更加方便经济。
2022年8月,复旦大学附属中山医院检验科郭玮教授在临床学杂志Clin Chim Acta上发表了重要研究成果,采用肺癌患者的组织和血液样本比较了Super-ARMS和BDA Sanger技术在检测EGFR突变中的表现,阐明了BDA Sanger测序是临床分子诊断的有效方法。

研究思路
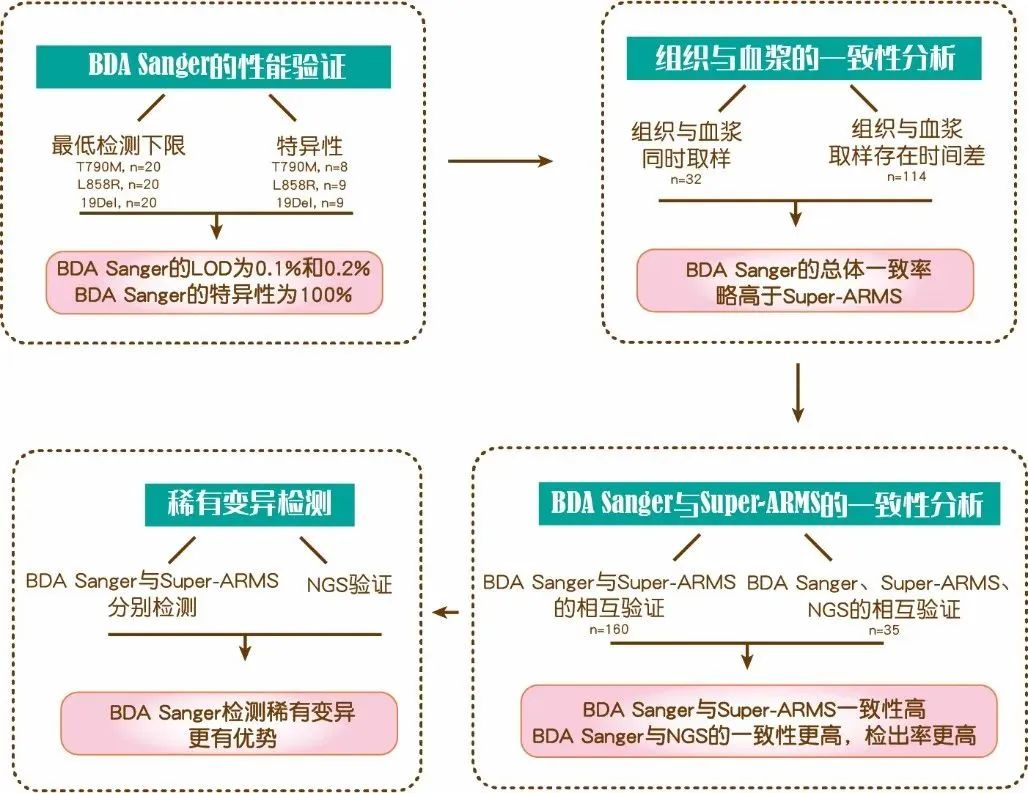
主要结果
将阳性标准品进行梯度稀释,制备MAFs为0.5%、0.2%、0.1%和0.05%的参照样品。以95%稳定检出作为最低检测下限的判定标准。BDA Sanger 可稳定检出T790M 突变频率为0.1%,L858R突变品频率为0.2%,19del突变频率为0.2%的样本(图1,表1)。以上检测经20次重复均可达到一致结果。利用26个野生型样本进行检测以验证BDA Sanger的特异性,26个样本均为阴性(表1)。

图1 BDA Sanger技术的最低检测限,编辑自表1
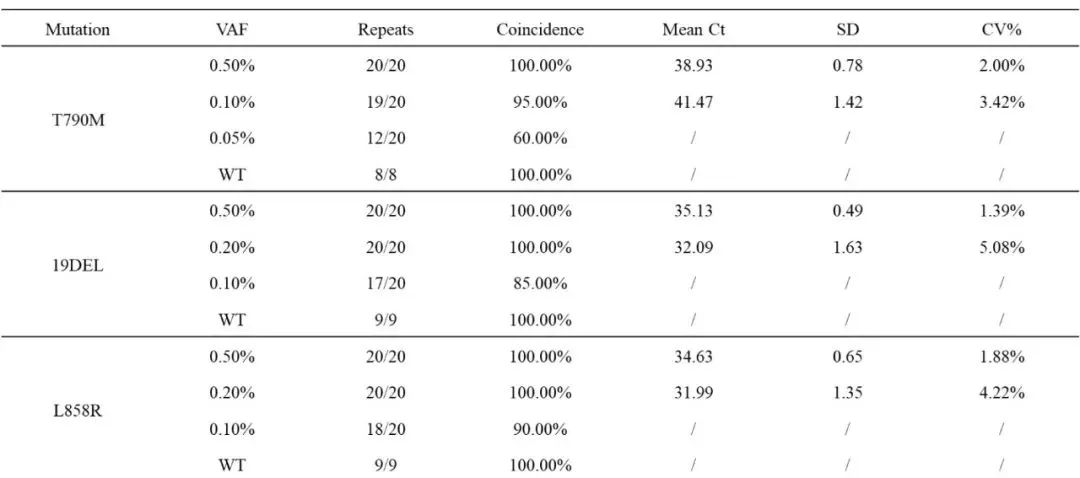
表1 BDA Sanger的性能验证
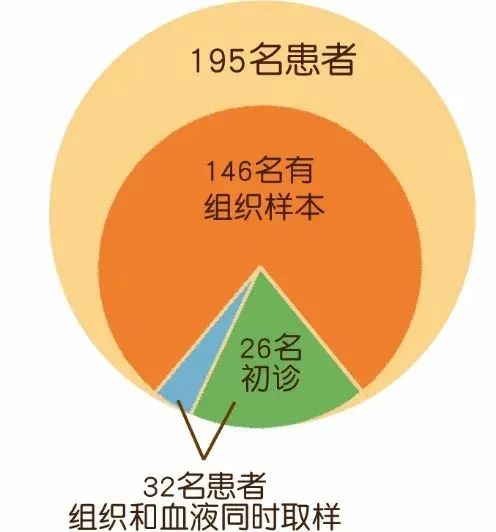
该研究共纳入195名肺癌患者,所有患者均使用血浆样本做了检测,其中146名患者使用组织样本做了检测,125名检测到EGFR 突变。146名患者中32名为组织和血液同时取样,114名患者的两个取样时间存在时间差。32名同时取样的患者中,26名为初诊未进行治疗的患者(图2)。
在32个同时取样的患者中,12个组织样本检测为EGFR野生型,Super-ARMS和BDA Sanger检测血浆样本的EGFR也均为野生型;20个组织样本检测为EGFR突变型,Super-ARMS和BDA Sanger均检出13个EGFR为突变型,另外7个为野生型。两个技术针对组织与血液的检出一致性均为78%(25/32)(图3A,B)。其中26个初诊患者中,12个EGFR组织检测为阴性的,Super-ARMS和BDA Sanger血浆中均检出阴性;14个组织检测为EGFR突变的,Super-ARMS和BDA Sanger血浆中均检出11个EGFR突变,3个EGFR野生型。两者组织与血液的检出结果一致性均为88%(23/26)(图3C,D)。
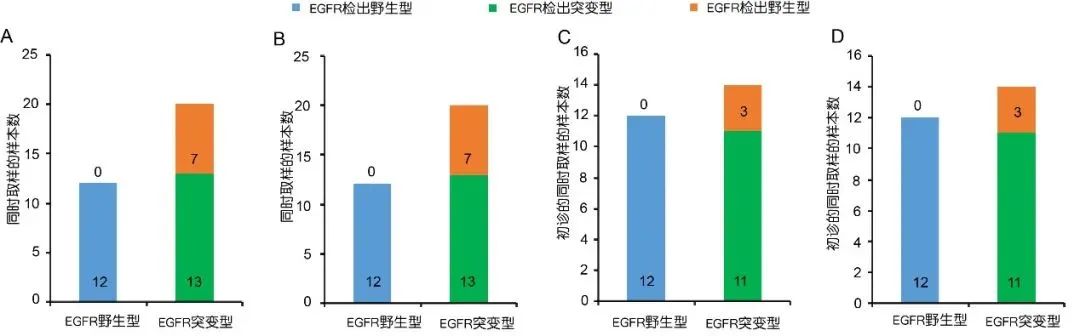
图3 同时取样的样本的组织和血液的一致性分析
A: Super-ARMS对同时取样的所有患者的一致性分析;
B: BDA Sanger对同时取样的所有患者的一致性分析;
C: Super-ARMS对初诊患者的一致性分析;
D: BDA Sanger对初诊患者的一致性分析。
编辑自原文表2
另外取样存在时间差的114个患者中,Super-ARMS检出19del突变一致的样本为13个,L858R一致的样本为14个,L861Q突变一致的样本为1个,8个样本为组织和血液检测均为阴性,总体一致率为31.58%(36/114)。BDA Sanger检出19del突变一致的样本为12个,L858R一致样本为17个,L861Q突变一致样本为1个,8个样本为组织和血液检测均为阴性,总体一致率为33.33%(38/114)(表2)。
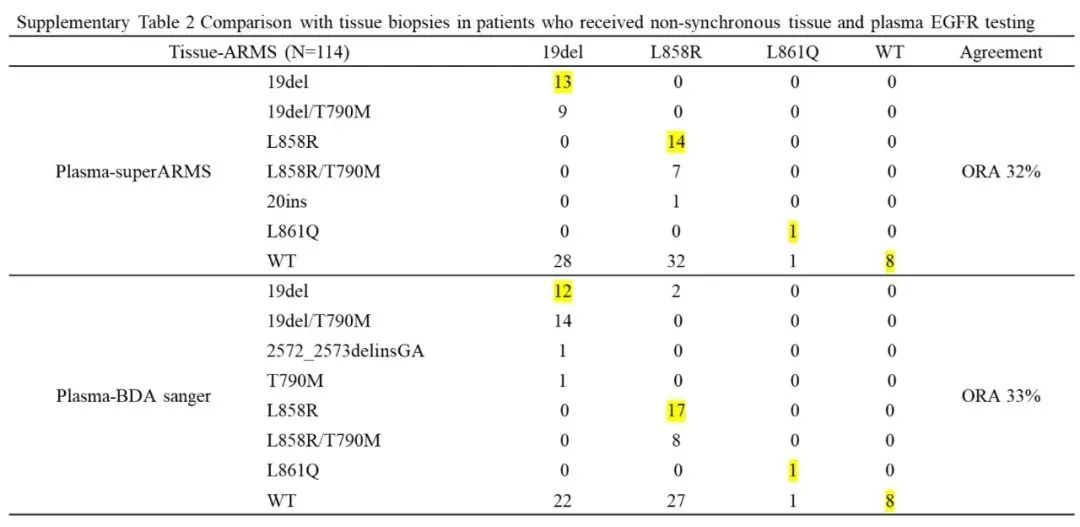
表2 非同时取样的样本的组织与血液一致性分析
注:黄色底纹标注为组织和血液检测一致的样本
为进一步验证BDA Sanger的检测性能,首先针对195个血浆样本分别使用BDA Sanger和Super-ARMS检测,验证两者的一致性。结果显示Super-ARMS检测到34.4%(67/195)的患者存在EGFR 突变,BDA Sanger检测出41.0%(80/195)的患者存在EGFR突变, BDA Sanger与Super-ARMS检测结果的总体一致率为82%(160/195),19del检出的一致率为95%(185/195),L858R为93%(182/195),T790M为94%(183/195),20ins为99%(193/195),L861Q为99%(193/195),BDA Sanger与Super-ARMS具有较高的一致性。此外,BDA的检出率略高,各个不同类型的突变均是BDA有略高的检出率。
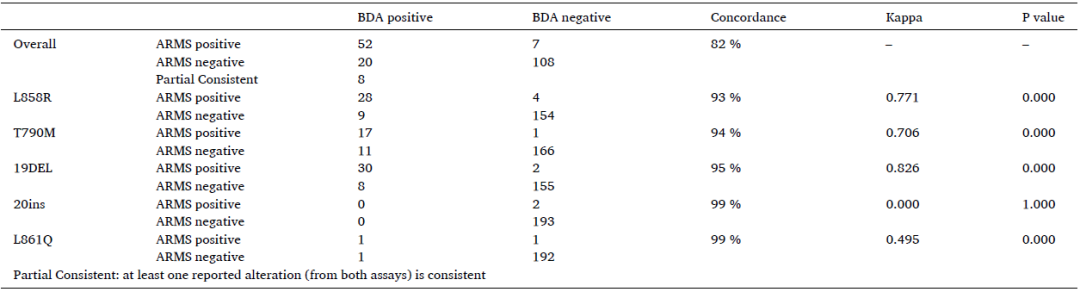
表3 BDA Sanger和Super-ARMS检测EGFR突变的一致性
针对BDA Sanger和Super-ARMS结果不一致的35个样本,使用NGS检测技术进行验证,至少有两种方法检测到的变异判定为阳性,不足两种方法检测到变异为阴性,所有NGS检测阳性的样本,BDA Sanger均检出阳性,而Super-ARMS均未检出阳性,BDA Sanger与NGS具有更好的一致性,其检出率更高(图4)。
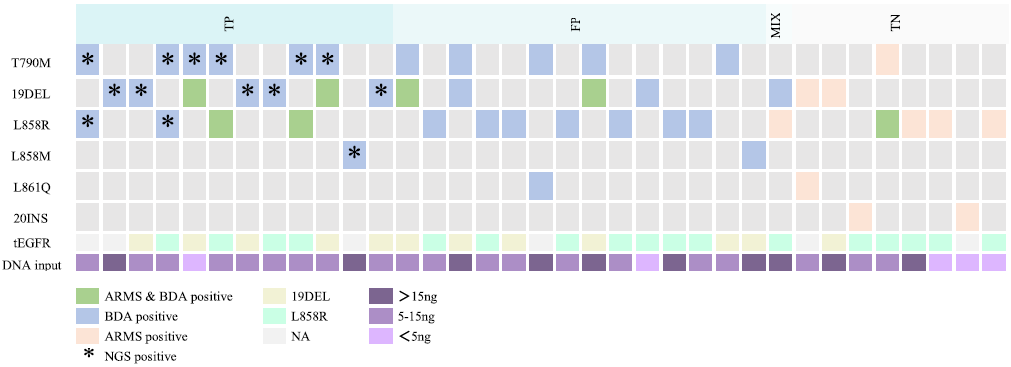
图4 35例样本的BDA Sanger、Super-ARMS和NGS检测EGFR突变
针对所有样本进行BDA Sanger、 Super-ARMS和NGS三种方法的两两验证。BDA Sanger和Super-ARMS均检出阳性的判定为TP(True Positive),BDA Sanger和Super-ARMS均检出阴性的判定为TN(True Negative);BDA Sanger和Super-ARMS检出结果不一致的,以NGS作为第三方验证。与NGS检出一致为阳性的判定为TP,与NGS检出一致为阴性的判定为TN。BDA Sanger检出TP的样本是89个,Super-ARMS检出TP的样本是76个。BDA Sanger的灵敏度为97.80%,特异性为98.42%;Super-ARMS的灵敏度为85.39%,特异性为99.07%(表4),BDA Sanger的灵敏度高于Super-ARMS,即检出率更高。
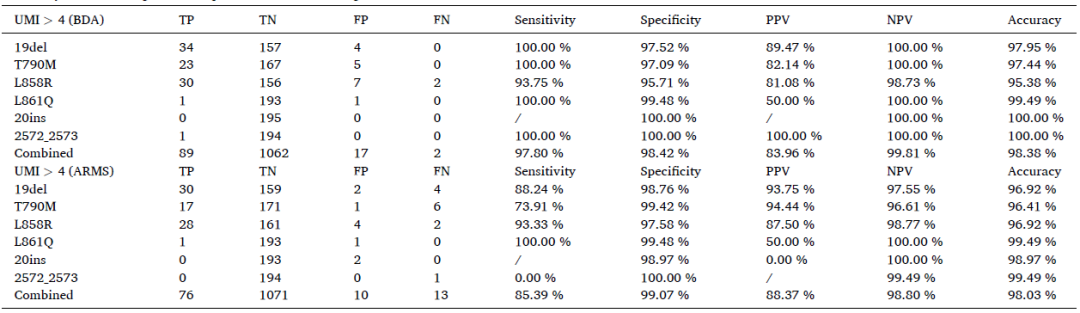
表4 BDA Sanger和Super-ARMS的灵敏度和特异性
此外,一例BDA Sanger检测阳性,Super-ARMS检测阴性的样本,经NGS复核其存在突变,并且为L858R稀有变异(2572_2573 delinsAG)。BDA Sanger可检测到2572_2573 delinsAG变异,该位点变异在蛋白水平依旧是L858R突变,此情况可使患者从EGFR TKI治疗中获益(图5)。因变异在Super-ARMS的引物识别位点之外,Super-ARMS对突变型序列无法有效扩增而被判读为野生型序列。BDA技术仅抑制野生型序列,对于多种不同突变型序列均可进行富集,在鉴定局部范围内的稀有突变位点方面具有更显著的优势。
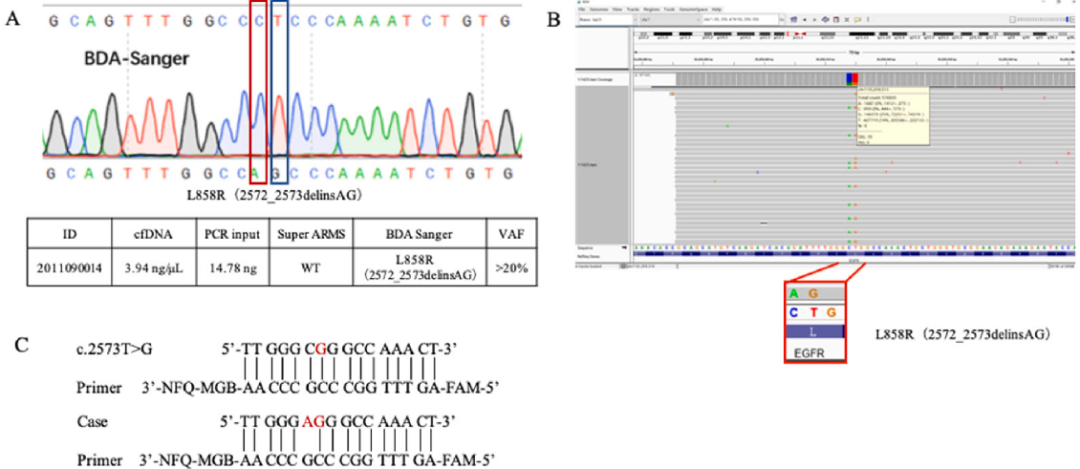
图5 BDA Sanger、NGS、Super-ARMS检测EGFR L858R稀有变异(2572_2573 delinsAG)
文章结论
BDA Sanger技术是一项可利用金标准测序技术Sanger测序开展液体活检的技术,可稳定检出血浆中0.1% VAF的EGFR突变,与组织样本的阳性一致率高达79%,与Super-ARMS检测血浆中EGFR突变的总体一致性为82%。采用NGS作为第三方验证平台,BDA Sanger的检出率略高于Super-ARMS。BDA Sanger技术比Super-ARMS能够检出更多的未知突变。
【参考文献】:
1. Wu LR, Chen SX, Wu Y, Patel AA, Zhang DY. Multiplexed enrichment of rare DNA variants via sequence-selective and temperature-robust amplification. Nat. Biomed. Eng., 2017, 1: 714-723.
来源:阅尔基因